Mycobacterium tuberculosis (Mycobacterium tuberculosis)
| Mycobacterium tuberculosis | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
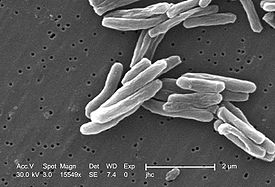 M. tuberculosis 15549x, СЭМ | ||||||||||
| Научная классификация | ||||||||||
|
Домен: Тип: Класс: Порядок: Семейство: Род: Вид: Mycobacterium tuberculosis |
||||||||||
| Международное научное название | ||||||||||
| Mycobacterium tuberculosis (Zopf 1883) Lehmann and Neumann 1896 | ||||||||||
| Синонимы | ||||||||||
|
||||||||||
| ||||||||||
Mycobactérium tuberculósis (лат.), па́лочка Ко́ха (МБТ, BK) — вид микобактерий, типовой вид семейства Mycobacteriaceae, выделен 24 марта 1882 года Робертом Кохом (24 марта объявлено ВОЗ Всемирным днём борьбы с туберкулёзом).
Входит в группу близкородственных видов MTBC (англ. Mycobacterium tuberculosis complex), (M. tuberculosis, M. bovis, M. africanum, M. microti, M. pinnipedii и M. caprae), способных вызывать туберкулёз у человека и некоторых животных. Является наиболее изученным видом из этой группы.
Бактерии, входящие в MTBC, имеют высокую степень родства (порядка 99,9 %) и идентичны по последовательностям 16S рРНК.
Морфология возбудителя туберкулёза
[править | править код]В статье есть список источников, но в этом разделе не хватает сносок. |
МБТ относятся к прокариотам (в их цитоплазме нет высокоорганизованных органелл — аппарата Гольджи, лизосом). Отсутствуют также характерные для части прокариотов и некоторых других видов микобактерий плазмиды, обеспечивающие для микроорганизмов динамику генома. В сущности, элементы динамики генома обеспечивается способностью МБТ к мутации, а точнее к перемещению транспозонной последовательности IS6110, что обеспечивает наличие в популяции особей с генами, «выключенными» из работы, что обеспечивает, например, устойчивость особей к тем или иным антибиотикам.
Форма — слегка изогнутая или прямая палочка 1 — 10 мкм диаметром 0,2 — 0,6 мкм. Клетки с характерным свойством кислото и спиртоустойчивой (на одной из стадий роста) окраски, являются аэрофилами и мезофилами (диапазон температур 37 — 42 °C), однако в процессе жизнедеятельности в неблагоприятных условиях метаболизм может измениться, а клетки трансформироваться в микроаэрофилы и даже становиться анаэробами. По потреблению кислорода и развитости оксидазных систем микобактерии схожи с истинными грибами. В качестве связующего звена между НАДН-дегидрогеназой и цитохромом b в переносящей системе рода Mycobacterium служит Витамин K9. Эта система цитохромов напоминает митохондриальную эукариот. Она чувствительна к динитрофенолу, так же как и у высших организмов. Описанный тип дыхания — не единственный источник образования АТФ. Кроме O2-терминальной, микобактерии могут использовать дыхательные цепи, переносящие электроны и оканчивающиеся нитратами (NO3−). Резервом дыхательной системы микобактерий является ещё и глиоксилатный цикл. Бескислородное (эндогенное) дыхание, проявляющееся в атмосфере с концентрацией кислорода менее 1 %, стимулирует азидные соединения, которые уменьшают окисление пирувата или трегалозы.
Тинкториально — слабо грамположительные. Для дифференцировки окрашивают по Цилю — Нельсену или используют окраску флюорохромами.


Микобактерии неподвижны, не образуют спор и капсул. Конидии также отсутствуют. Растут на плотных питательных средах медленно: при оптимальной температуре видимые колонии появляются через 34—55 сут (присутствие в среде L-аспарагина или глутамината натрия ускоряет рост на плотных средах в 1,5 раза). Колонии чаще характерного цвета «слоновой кости», но бывают слабо пигментированные розовые или оранжевые, особенно при росте на свету.

Пигмент не диффундирует. Поверхность колоний обычно шероховатая (R-тип). В микроколониях М. tuberculosis (то есть на ранних сроках) и в жидких питательных средах образуются структуры, напоминающие «косы» или «жгуты» — признак, который связывают с корд-фактором.

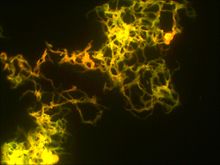
Нередко микобактерии растут в виде слизистых или морщинистых колоний. На жидких средах микобактерии могут расти на поверхности. Нежная сухая плёнка со временем утолщается, становится бугристо-морщинистой и обретает желтоватый оттенок. Бульон остаётся прозрачным, и добиться диффузного роста удаётся в присутствии детергентов (ПАВ). При окраске карболовым фуксином и метиленовым синим микобактерии туберкулёза выявляются в виде тонких, слегка изогнутых палочек малиново-красного цвета, содержащих различное количество гранул. Иногда можно обнаружить изогнутые или извитые варианты. Микроорганизмы, располагающиеся поодиночке, парами или в виде групп, хорошо выделяются на голубом фоне других компонентов препарата. Нередко бактериальные клетки могут располагаться в виде римской цифры «V». В препарате можно выявить также изменённые кокковидные кислотоустойчивые формы возбудителя, округлые сферические или мицелиеподобные структуры. В этом случае положительный ответ должен быть подтверждён дополнительными (культуральными) методами исследования[2].
В бактериальной клетке дифференцируется:
- клеточная стенка — состоящая из 3—4 связанных слоёв толщиной до 200—250 нм, содержит специфичные воска (микозиды) полисахариды, защищает микобактерию от воздействия внешней среды, обладает антигенными свойствами и проявляет серологическую активность; ограничивает микобактерию снаружи, обеспечивает стабильность размеров и формы клетки, механическую, осмотическую и химическую защиту, включает факторы вирулентности — липополисахариды, с фосфатидной фракцией которых связывают вирулентность микобактерий;
- бактериальная цитоплазма; может содержать гранулы;
- цитоплазматическая мембрана — включает липопротеиновые комплексы, ферментные системы, формирует внутрицитоплазматическую мембранную систему (мезосому);
- ядерная субстанция — состоит из одной кольцевой ДНК.
Белки (туберкулопротеины) являются главными носителями антигенных свойств МБТ и проявляют специфичность в реакциях повышенной чувствительности замедленного типа. К этим белкам относится туберкулин. С полисахаридами связано обнаружение антител в сыворотке крови больных туберкулёзом. Липидные фракции способствуют устойчивости микобактерий к кислотам и щелочам.
Метаболизм и развитие МБТ в разных условиях
[править | править код]В разделе не хватает ссылок на источники (см. рекомендации по поиску). |
МБТ не выделяют эндо- и экзотоксинов, поэтому при инфицировании ими ярких клинических симптомов, как правило, не возникает. По мере размножения МБТ и формирования повышенной чувствительности тканей к туберкулопротеинам возникают первые признаки инфицирования (положительная реакция на туберкулин).
МБТ размножаются простым делением на две клетки. Цикл деления — 14—18 часов. Иногда размножение происходит почкованием, редко ветвлением.
МБТ весьма устойчивы к воздействию факторов внешней среды. Вне организма сохраняют жизнеспособность много дней, в воде — до 5 месяцев. Но прямой солнечный свет убивает МБТ в течение полутора часов, а ультрафиолетовые лучи — за 2—3 минуты. Кипящая вода вызывает гибель МБТ во влажной мокроте через 5 минут, в высушенной — через 25 минут. Дезинфектанты, содержащие хлор, убивают МБТ в течение 5 часов.
МБТ, поглощённые макрофагами в процессе фагоцитоза, сохраняют свою жизнеспособность длительное время и могут вызывать заболевание после нескольких лет бессимптомного существования.
МБТ могут образовывать L-формы, имеющие сниженный уровень метаболизма и ослабленную вирулентность. L-формы могут длительное время персистировать (сохраняться) в организме и индуцировать (вызывать) противотуберкулёзный иммунитет.
МБТ могут существовать в виде очень мелких фильтрующихся форм, которые выделяются у больных, длительно принимавших противотуберкулёзные препараты.
Генетика и эволюция Mycobacterium tuberculosis
[править | править код]В статье есть список источников, но в этом разделе не хватает сносок. |
Разнообразие свойств данного микроорганизма определяется её хромосомой. Геном M. tuberculosis complex очень консервативен. Его представители обладают гомологией ДНК в пределах 85—100 %, тогда как ДНК других представителей данного рода гомологичны M. tuberculosis лишь на 5—29 %[3]. Геном M. tuberculosis меньше, чем у других микобактерий. У классического возбудителя туберкулёза человека, M. tuberculosis, больше генов, чем у M. africanum и M. bovis, которые утратили часть генетического материала в ходе эволюции.
В 1998 г. была опубликована нуклеотидная последовательность хромосомы штамма H37Rv M. tuberculosis, являющегося музейным «классическим» штаммом. Хромосома представляет собой тороидальную структуру — свыше 4000 генов, кодирующих белки, плюс 60, кодирующих функциональные компоненты РНК: уникальный рибосомальный РНК-оперон, 10Sа РНК, участвующий в деградации белков с нетипичной матричной РНК, 45 транспортных РНК (тРНК), около 100 липопротеинов.
Особенность генома M. tuberculosis complex — большое число повторяющихся последовательностей ДНК. Так, в хромосоме M. tuberculosis Н37Rv насчитывают до 56 копий IS-элементов, которые обеспечивают ДНК-полиморфизм микобактерий туберкулёза (эту особенность используют в ПЦР-диагностике). Большинство из них, за исключением элемента IS6110, неизменны. В составе хромосомы различных штаммов микобактерий туберкулёза, как правило, присутствует от 5 до 20 копий IS6110, однако встречаются штаммы, не имеющие данного элемента. Различия в количестве копий и локализации на хромосоме этих генетических элементов используют для дифференциации штаммов микобактерий туберкулёза в молекулярной эпидемиологии. Наиболее совершённые схемы генотипирования микобактерий основаны на выявлении геномного полиморфизма, обусловленного элементом IS6110. Дивергенция вида M. tuberculosis происходит, как правило, за счёт рекомбинаций между копиями элемента IS6110, которые фланкируют различные гены.
Фактически с самого начала применения антибиотикотерапии возник феномен лекарственной устойчивости. Феномен потому, что микобактерия не имеет плазмид, а популяционная устойчивость микроорганизмов к антибактериальным препаратам традиционно описывалась в микробной клетке наличием R-плазмид (от англ. resistance — устойчивость). Однако, несмотря на этот факт, отмечалось появление или исчезновение лекарственной устойчивости у одного штамма МБТ. В итоге выяснилось, что за активацию или дезактивацию генов, отвечающих за резистентность, ответственны IS-последовательности.
В употребление вошёл термин «мутации МБТ». Он означает выявленную генетическими методами (ДНК-зонды и ПЦР-РВ) устойчивость к антибактериальным препаратам, однако следует понимать, что здесь мы имеем дело с «псевдомутациями», обусловленными временным внедрением IS-последовательности в определённый участок гена.
Особое место занимает генетическое семейство Beijing (Пекин), впервые выявленное в гистологических препаратах лёгочной ткани в 1956—1990 гг. от больных предместья китайской столицы. В этой группе частота множественной лекарственной устойчивости значительно выше, чем среди представителей других семейств. На сегодняшний день штаммы этого семейства обнаружены в государствах Азии, Южной Африки, странах Карибского бассейна, США. Распространение данного генотипа на различных территориях определяется этническими характеристиками коренного населения и мигрантов. Недавно получены данные о распространении штаммов генотипа S1/Beijing на северо-западе европейской части России (Санкт-Петербург), некоторых регионах Сибири, а также на территории Дальневосточного федерального округа.
Молекулярный патогенез: взаимодействие микобактерий с клеткой
[править | править код]В разделе не хватает ссылок на источники (см. рекомендации по поиску). |
Микобактерии туберкулёза относят к внутриклеточной инфекции, с чем связывают их высокую способность к персистенции. Первично инфицируют макрофаги хозяина, развивая особые стратегии выживания и размножения в этих высокоспециализированных клетках. Используя способность макрофагов образовывать специализированные органеллы — фагосомы, микобактерии приспособили эти органеллы для своей жизнедеятельности, при этом получая несомненные преимущества, необходимые для избегания действия защитных «хозяйских» механизмов, таких как антитела и система комплемента.
При помощи маннозного рецептора, а также рецепторов системы комплемента (CR1, CR3 и CR4) микобактерии связываются с мембраной макрофага и фагоцитируются внутрь клетки. Внутри фагосомы микобактерии производят её ремоделинг таким образом, что нарушают процесс её созревания и дальнейшее слияние с лизосомой для образования фаголизосомы.
Микобактериальная фагосома
[править | править код]В разделе не хватает ссылок на источники (см. рекомендации по поиску). |
В отличие от нормальной фагосомы, микобактериальная имеет значительные различия в составе мембран и их внутреннего содержимого. Микобактерии задерживают созревание фагосомы на ранней стадии, не позволяя ей в дальнейшем слиться с лизосомой для образования фаголизосомы, в которой происходит лизис клеток микроорганизмов. Поэтому эта фагосома имеет маркеры раннего этапа созревания (англ. early endosome), такие как rab5, coronin-1, кроме того, существует активное взаимодействие между ранними эндосомами и микобактериальной фагосомой, что обеспечивает микобактерии питательными веществами.
Жизнестойкость
[править | править код]МБТ очень устойчива в окружающей среде, и выдерживает даже температуру жидкого воздуха (-180°C) в течение нескольких недель. Высушенные в вакууме могут сохранять патогенные свойства до 18 лет[4]. M. avium могут сохраняться в унавоженной почве до 9 лет.[4]
В тёмном и сухом месте (при высыхании мокроты больного или в пыли) МБТ сохраняется до 10—12 месяцев, в уличной пыли (то есть в сухом и светлом месте) палочка Коха сохраняется до 2 месяцев, на страницах книг — до 3 месяцев, в воде — до 5 месяцев.[5]
В глинистых почвах M.bovis сохраняется до 23 месяцев[4], в сыром молоке — до 2 недель, в молочных продуктах, замороженных до -8°C, до 120 дней[4], в масле и сыре — до года.
На сегодняшний день считают, что микобактерии туберкулёза, находящиеся в высохшей мокроте, остаются жизнеспособными при открытом кипячении последней в пределах 25 минут. Микобактерии чувствительны к средствам, содержащим хлор (хлорная известь, хлорамин и др.) и третичные амины, а также к перекиси водорода.[5] В 20%-м растворе хлорной извести культура МБТ гибнет в течение 3-5 часов.
Культивация
[править | править код]В качестве стандартной среды для культивирования микобактерий туберкулёза ВОЗ рекомендована плотная яичная среда Левенштейна — Йенсена. В России и некоторых других странах широкое распространение получила рекомендованная в качестве второй стандартной яичная среда Финна-II с несколько более высоким процентом выделения микобактерий[6][7]. Для повышения вероятности роста микобактерий в настоящее время рекомендуется засеивание патологического материала на 2—3 среды одновременно.
Примечания
[править | править код]- ↑ LPSN: Genus Mycobacterium. Дата обращения: 21 июня 2015. Архивировано 5 июля 2017 года.
- ↑ Л. Б. Борисов. Медицинская микробиология, вирусология и иммунология. — МИА, 2005. — С. 154—156. — ISBN 5-89481-278-X.
- ↑ М. И. Перельман. Национальное руководство. Фтизиатрия. — М.: ГЭОТАР-Медиа, 2007. — С. 75—91. — ISBN 978-5-9704-0490-4.
- ↑ 1 2 3 4 Р. А. Нуратинов, Н. Х. Месробян. Экологические аспекты существования популяции микобактерий (Россия) // Туберкулёз и болезни лёгких : журнал. — М.: ООО «НЬЮ ТЕРРА», 2014. — № 2. — С. 3-9. — doi:10.21292/2075-1230-2014-0-2-43-47. Архивировано 12 декабря 2021 года.
- ↑ 1 2 Акад. РАМН А. Г. Хоменко, чл.-корр. РАМН В. И. Литвинов. ТУБЕРКУЛЕЗ / под ред. акад. РАН Е. И. Чазова. — М.: Медицина, 1996. — 496 с. — ISBN 5-225-00967-0.
- ↑ О совершенствовании противотуберкулезных мероприятий в Российской Федерации. — N 109. — Минздрав РФ, 21.03.2003.
- ↑ Среды для культивирования микобактерии туберкулёза. Дата обращения: 4 декабря 2010. Архивировано из оригинала 16 июня 2013 года.
Литература
[править | править код]- Hestvik AL, Hmama Z, Av-Gay Y. Mycobacterial manipulation of the host cell. FEMS Microbiol Rev. 2005 Nov;29(5):1041-50. PMID 16040149
- Vergne I, Chua J, Singh SB, Deretic V. Cell biology of mycobacterium tuberculosis phagosome. Annu Rev Cell Dev Biol. 2004;20:367-94. PMID 15473845
- Kusner DJ. Mechanisms of mycobacterial persistence in tuberculosis. Clin Immunol. 2005 Mar;114(3):239-47. PMID 15721834
- Houben EN, Nguyen L, Pieters J.Interaction of pathogenic mycobacteria with the host immune system.Curr Opin Microbiol. 2006 Feb;9(1):76-85. PMID 16406837
- Russell DG. Mycobacterium tuberculosis: here today, and here tomorrow. Nat Rev Mol Cell Biol. 2001 Aug;2(8):569-77. PMID 11483990
Ссылки
[править | править код]- TB database: an integrated platform for Tuberculosis research (англ.)
- Photoblog about Tuberculosis (англ.)
- Mycobacterium tuberculosis. NCBI Taxonomy Browser.
- Database on Mycobacterium tuberculosis genetics (англ.)