2-Меркаптоэтанол (2-Byjtghmkzmgukl)
| 2-Меркаптоэтанол | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
2-сульфанилэтан-1-ол | ||
| Хим. формула | С2H6SO | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 78,133 г/моль | ||
| Плотность | 1,114 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −100 °C | ||
| • кипения | 157 °C | ||
| Классификация | |||
| Рег. номер CAS | 60-24-2 | ||
| PubChem | 1567 | ||
| Рег. номер EINECS | 200-464-6 | ||
| SMILES | |||
| InChI | |||
| RTECS | KL5600000 | ||
| ChEBI | 41218 | ||
| Номер ООН | 2966 | ||
| ChemSpider | 1512 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
2-меркаптоэтанол (β-меркаптоэтанол, BME, 2BME, 2-ME, β-met) — химическое сераорганическое соединение, производное этиленгликоля и этандитиола[англ.]. Восстанавливающий агент, используемый для восстановления дисульфидных связей. Антиоксидант, используемый для деактивации свободных радикалов. Широко используется, так как гидроксильная группа обеспечивает хорошую растворимость в воде и снижает летучесть. Как и большинство тиолов имеет неприятный запах.
Синтез
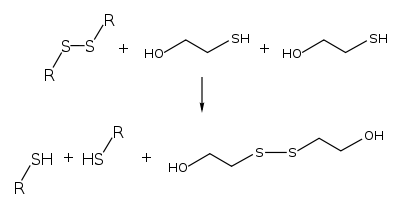
[править | править код]2-меркаптоэтанол может быть синтезирован в реакции сероводорода с оксидом этилена[1]:
Химические свойства
[править | править код]2-меркаптоэтанол взаимодействует с альдегидами и кетонами. Данная реакция делает меркаптоэтанол важной защитной группой[2].
Применение
[править | править код]Восстановление дисульфидных связей в белках
[править | править код]Некоторые белки денатурируют в присутствии 2-меркаптоэтанола из-за восстановления дисульфидных связей:
Восстановление дисульфидных связей приводит к разрушению третичной и четвертичной структуры белков.[3] Поэтому меркаптоэтанол часто используют при исследовании структуры белков, например, для перевода всех молекул белка из олигомерного в мономерное состояние. Однако, из-за того, что 2-меркаптоэтанол образует аддукты со свободными цистеинами и является более токсичным, чем дитиотреитол, в молекулярной биологии и биохимии чаще используют последний, особенно при анализе белков в полиакриламидном геле. Дитиотреитол также является более мощным восстановителем, и имеет при рН 7 восстановительный потенциал −0,33 В, в то время как 2-меркаптоэтанол −0,26 В.[4]
В биохимических исследованиях также используют трис(2-карбоксиэтил)фосфин (англ. TCEP), который не обладает неприятным запахом.
2-меркаптоэтанол более стабилен, чем дитиотреитол (2-ME: t1/2>100 часов при pH 6,5, t1/2=4 часа при рН 8,5; DTT: t1/2=40 часов при pH 6,5, t1/2=1,5 часа при pH 8,5; Stevens et al., 1983), но более летуч.[5]
Предотвращение окисления белков
[править | править код]2-меркаптоэтанол и другие восстанавливающие агенты добавляют к компонентам ферментативных реакций для ингибирования окисления свободных сульфогидрильных остатков и поддержания белковой активности.
Денатурирование рибонуклеаз
[править | править код]2-меркаптоэтанол используют при выделении РНК для элиминирования РНКазы, которая освобождается при разрушении клеток. Он препятствует расщеплению РНК в процессе выделения[6].
Безопасность
[править | править код]2-меркаптоэтанол является токсичным веществом, вызывает раздражение дыхательных путей, кожи, боли в животе и потенциально может приводить к смертельному исходу[7].
Примечания
[править | править код]- ↑ Knight, J. J. «2-Mercaptoethanol» in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- ↑ 1,3-Dithiolanes, 1,3-Dithianes. Organic Chemistry Portal. Дата обращения: 27 мая 2008. Архивировано 17 мая 2008 года.
- ↑ 2-Mercaptoethanol. Chemicalland21.com. Дата обращения: 8 октября 2006. Архивировано 5 октября 2006 года.
- ↑ Aitken C. E., Marshall R. A., Puglisi J. D. An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments (англ.) // Biophys J[англ.] : journal. — 2008. — Vol. 94, no. 5. — P. 1826—1835. — doi:10.1529/biophysj.107.117689. — PMID 17921203. — PMC 2242739.
- ↑ Yeh, J. I. «Additives and microcalorimetric approaches for optimization of crystallization» in Protein Crystallization, 2nd Edition (Ed: T. Bergfors) 2009, International University Line, La Jolla, CA. ISBN 9780972077446.
- ↑ Nelson, David R.; Lehninger, Albert L; Cox, Michael. Lehninger principles of biochemistry (англ.). — New York: W.H. Freeman[англ.], 2005. — P. 148. — ISBN 0-7167-4339-6.
- ↑ Material Safety Data Sheet. JT Baker. Дата обращения: 31 июля 2011. Архивировано 16 сентября 2012 года.