Электронная оболочка (|lytmjkuugx kQklkctg)
Электронная оболочка атома — область пространства наиболее вероятного нахождения электронов, имеющих одинаковое значение главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Число электронов в каждой электронной оболочке не может превышать определенного максимального значения.
Порядок заполнения электронных оболочек (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется правилом Хунда.
Оболочки
[править | править код]Электронные оболочки обозначаются буквами K, L, M, N, O, P, Q или цифрами от 1 до 7. Подуровни оболочек обозначаются буквами s, p, d, f, g, h, i или цифрами от 0 до 6. Электроны внешних оболочек обладают большей энергией, и, по сравнению с электронами внутренних оболочек, находятся дальше от ядра, что делает их более важными в анализе поведения атома в химических реакциях и в роли проводника, так как их связь с ядром слабее и легче разрывается.
Количество электронов в каждой оболочке
[править | править код]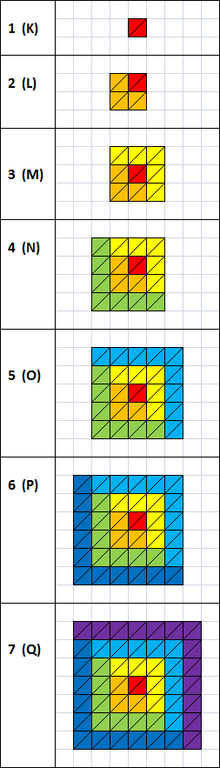
Данное количество вычисляется по формуле:
- , где N — номер оболочки.
| уровень/подуровень | 0 (s) | 1 (p) | 2 (d) | 3 (f) | 4 (g) | 5 (h) | 6 (i) | Итого в оболочке |
|---|---|---|---|---|---|---|---|---|
| 1 (K) | 2 | 2 | ||||||
| 2 (L) | 2 | 6 | 8 | |||||
| 3 (M) | 2 | 6 | 10 | 18 | ||||
| 4 (N) | 2 | 6 | 10 | 14 | 32 | |||
| 5 (O) | 2 | 6 | 10 | 14 | 18 | 50 | ||
| 6 (P) | 2 | 6 | 10 | 14 | 18 | 22 | 72 | |
| 7 (Q) | 2 | 6 | 10 | 14 | 18 | 22 | 26 | 98 |
Подуровни оболочек
[править | править код]Каждая оболочка состоит из одного или нескольких подуровней, каждый из которых состоит из атомных орбиталей. К примеру, первая оболочка (K) состоит из одного подуровня «1s». Вторая оболочка (L) состоит из двух подуровней, 2s и 2p. Третья оболочка (M) — из «3s», «3p» и «3d». Четвертая (N) - из «4s», «4p», «4d», «4f». Возможные варианты подуровней оболочек приведены в следующей таблице:
| Обозначение подуровня | l | Макс. кол-во электронов | Содержание в оболочках | Историческое наименование[1] |
|---|---|---|---|---|
| s | 0 | 2 | В каждой | sharp (резкая) |
| p | 1 | 6 | Во всех со 2-й | principal (главная) |
| d | 2 | 10 | Во всех с 3-й | diffuse (диффузная) |
| f | 3 | 14 | Во всех с 4-й | fundamental (фундаментальная) |
| g | 4 | 18 | Во всех с 5-й | (Тут и далее алфавитный порядок) |
| h | 5 | 22 | Во всех с 6-й | |
| i | 6 | 26 | Во всех с 7-й |
Таким образом, подуровни электронных оболочек атомов заполняются электронами по формуле
2 + 2²n
или
2 + 4n
где n — номер подуровня.
Валентные оболочки
[править | править код]Валентная оболочка — самая внешняя оболочка атома. Электроны этой оболочки зачастую неверно называют валентными электронами, то есть электронами, определяющими поведение атома в химических реакциях. С точки зрения химической активности, наименее активными считаются атомы, в которых валентная оболочка окончательно заполнена (инертные газы). Наибольшей химической активностью обладают атомы, в которых валентная оболочка состоит всего из одного электрона (щелочные металлы), и атомы, в которых для окончательного заполнения оболочки не хватает одного электрона (галогены).
Есть и другое объяснение. Поведение атома в химических реакциях определяют электроны, обладающие большей энергией, то есть те электроны, которые расположены дальше от ядра. Электроны внутренних подуровней оболочек имеют меньшую энергию, чем электроны внешних подуровней. Несмотря на то, что электроны подуровня оболочки 3d могут не принадлежать к так называемой валентной оболочке, они могут иметь энергию большую, чем электроны подуровня оболочки 4s, что делает их валентными электронами.
См. также
[править | править код]- Атомная орбиталь
- Квантовые числа
- Строение атома
- Электронная конфигурация атома
- Энергетические уровни электронов
Примечания
[править | править код]- ↑ Милантьев, Владимир Петрович. История возникновения квантовой механики и развитие представлений об атоме. — М.: Книжный дом «Либроком», 2009. — С. 188. — 248 с. — ISBN 978-5-397-00146-5.
