Хромат аммония (}jkbgm gbbkunx)
Перейти к навигации
Перейти к поиску
| Хромат аммония | |
|---|---|
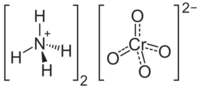 | |
 | |
| Общие | |
| Систематическое наименование |
Хромат аммония |
| Традиционные названия | Хромовокислый аммоний |
| Хим. формула | (NH4)2CrO4 |
| Физические свойства | |
| Состояние | жёлтые кристаллы |
| Молярная масса | 152,07 г/моль |
| Плотность | 1,89; 1,91 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | разл. 180 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 24,70; 70,175 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7788-98-9 |
| PubChem | 24595 |
| Рег. номер EINECS | 232-138-4 |
| SMILES | |
| InChI | |
| RTECS | GB2880000 |
| ChemSpider | 22997 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хромат аммония(II) — неорганическое соединение, соль аммония и хромовой кислоты с формулой (NH4)2CrO4, жёлтые кристаллы, растворимые в воде.
Получение
[править | править код]- Растворение оксида хрома(VI) в избытке раствора аммиака:
Физические свойства
[править | править код]Хромат аммония(II) образует жёлтые кристаллы моноклинной сингонии, пространственная группа P m, параметры ячейки a = 0,744 нм, b = 0,627 нм, c = 0,615 нм, β = 113,17°, Z = 2.
Хорошо растворяется в воде, плохо растворим в этаноле и ацетоне.
Химические свойства
[править | править код]- При нагревании разлагается
- При длительном хранении на воздухе постепенно теряет аммиак и превращается в бихромат аммония:
- Реагирует с разбавленными кислотами:
- Легко образует двойные хроматы, например, с раствором нитрата никеля(II):
Применение
[править | править код]- Протрава при крашении тканей.
- Дубящее вещество.
- Компонент светочувствительного слоя фотоматериалов.
Литература
[править | править код]- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- Неорганическая химия / под ред. Ю.Д. Третьякова. — М.: Академия, 2007. — Т. 3. — 352 с.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |
![{\displaystyle {\mathsf {CrO_{3}+2[NH_{3}\cdot H_{2}O]\ \xrightarrow {} \ (NH_{4})_{2}CrO_{4}+H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a2f4a20e8b8e88950a9edf02743a66fc7f4bc59e)



