Уропорфириноген III синтаза (Rjkhkjsnjnukiyu III vnumg[g)
| Уропорфириноген III синтаза | |
|---|---|
 УПГ-III-синтаза мономер, из Thermus thermophilus | |
| Идентификаторы | |
| Шифр КФ | 4.2.1.75 |
| Номер CAS | 37340-55-9 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 37340-55-9 |
| Уропорфириноген III синтаза | |
|---|---|
| Обозначения | |
| Символы | UROS |
| Entrez Gene | 7390 |
| HGNC | 12592 |
| OMIM | 606938 |
| RefSeq | NM_000375 |
| UniProt | P10746 |
| Другие данные | |
| Шифр КФ | 4.2.1.75 |
| Локус | 10-я хр. , 10q25.2-26.3 |
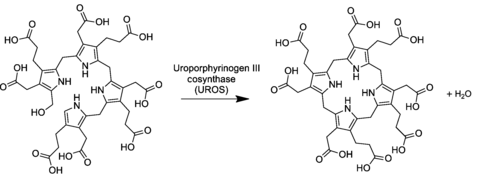
Уропорфириноген III синтаза (сокр. УПГ-III-синтаза) — фермент (КФ 4.2.1.75) из класса лиазы, который катализирует реакцию циклизации линейных молекул гидроксиметилбилана в уропорфириноген III. При катализе происходит инверсия конечного пиррольного звена (кольцо D) линейной молекулы гидроксиметилбилана, связывая его с первым пиррольным звеном (кольцо А), тем самым образуя крупную макроциклическую структуру, уропорфириноген III[1].
Фермент имеет укладку, которая включает два альфа/бета домена, соединённых бета-лестницей, при этом активный сайт располагается между двумя доменами[2]. Ген UROS, кодирующий данный фермент, локализован на длинном плече (q-плече) 10-й хромосомы. УПГ-III-синтаза является цитоплазматическим ферментом, она обнаруживается практически во всех клетках организма человека, однако, наиболее интенсивно её синтез протекает в клетках эритропоэтической ткани красного костного мозга и гепатоцитах печени.
Патология
[править | править код]Дефицит фермента связан с болезнью Гюнтера, также известной как врождённая эритропоэтическая порфирия (ВЭП). Это генетическое заболевание с аутосомно-рецессивным характером наследования, при котором наблюдается нарушение биосинтеза гема и накопление уропорфирина I в тканях (коже, зубной эмали), возникающее в результате выраженного дефицита активности уропорфириноген III синтазы[3].
Примечания
[править | править код]- ↑ Raux E, Schubert HL, Warren MJ (December 2000). "Biosynthesis of cobalamin (vitamin B12): a bacterial conundrum". Cell. Mol. Life Sci. 57 (13—14): 1880—93. doi:10.1007/PL00000670. PMID 11215515. S2CID 583311.
- ↑ Mathews MA, Schubert HL, Whitby FG, Alexander KJ, Schadick K, Bergonia HA, Phillips JD, Hill CP (November 2001). "Crystal structure of human uroporphyrinogen III synthase". EMBO J. 20 (21): 5832—9. doi:10.1093/emboj/20.21.5832. PMC 125291. PMID 11689424.
- ↑ To-Figueras J, Badenas C, Mascaro JM, Madrigal I, Merino A, Bastida P, Lecha M, Herrero C (2007). "Study of the genotype-phenotype relationship in four cases of congenital erythropoietic porphyria". Blood Cells Mol. Dis. 38 (3): 242—6. doi:10.1016/j.bcmd.2006.12.001. PMID 17270473.