Тиаминаза (Mngbnug[g)
| Тиаминаза I | |
|---|---|
 Схема расщепления витамина B1 под влиянием тиаминазы | |
| Идентификаторы | |
| Шифр КФ | 2.5.1.2 |
| Номер CAS | 9030-35-7 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9030-35-7 |
| Тиаминаза II | |
|---|---|
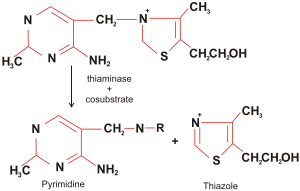 Расщепление тиамина под влиянием тиаминазы и косубстрата | |
| Идентификаторы | |
| Шифр КФ | 3.5.99.2 |
| Номер CAS | 9024-80-0 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9024-80-0 |
Тиамина́за — ферментный антагонист витамина В1. Это фермент класса гидролаз, катализирующий гидролиз тиамина. Тиаминаза разрушает тиамин, катализируя реакцию нуклеофильного замещения у метиловой группы с образованием неактивных соединений — свободного тиазола и сульфокислоты.
Типы тиаминазы
[править | править код]Различают два типа тиаминазы[1]:
1. Тиаминаза I (англ. thiamine pyridinylase) — Шифр КФ 2.5.1.2 — самый распространенный тип. Он действует путем вытеснения пиримидиновых метильных групп с азотистым основанием или SH-соединений для разрушения тиазольного кольца.
Синонимы Тиаминазы I:
Протеины: пиримидин трансфераза, тиамин гидроназа
Альтернативное название: тиамин основание 2-метил-4-аминопиримидин-5-метилтрансфераза (англ. thiamine:base 2-methyl-4-aminopyrimidine-5-methenyltransferase)
2. Тиаминаза II (англ. aminopyrimidine aminohydrolase) — Шифр КФ 3.5.99.2 — этот тип действует через гидролитическое расщепление метилен-тиазол-Н соединений с образованием фрагментов пиримидина и тиамина.
Синонимы Тиаминазы II:
Протеины: аневриназа (уст.), анзериназа (уст.), тиамин гидроназа
Альтернативное название: 4-амино-5-аминометил-2-метилпиримидин гидролаза (англ. 4-amino-5-aminomethyl-2-methylpyrimidine hydrolase)
Ген: tenA (Локус: BSU11650)
При расщеплении тиамина оба типа тиаминазы используют косубстраты (обычно амин или сульфгидрил-содержащие соединения). Например пролин или цистеин.
Источники фермента
[править | править код]Полный перечень природных источников тиаминазы ещё не определен. Фермент представлен в нескольких формах и доказанно содержится в тканях многих пресноводных и морских рыб. Особенно её много в карпе, атлантической сельди, моллюсках (Тип I)[2].
Тиаминаза обнаруживается в клетках животных и человека — в норме она регулирует содержание соответствующих коферментов. Она продуцируется бактериями кишечного тракта — Bacteria thiaminolytic и Bacteria anekrinolytieny (Тип II)[3]. Источником тиаминазы может быть золотистый стафилококк, сальмонелла, протеус, некоторые штаммы кишечной палочки. Эти тиаминразрушающие бактерии выявляют в кишечнике детей, страдающих расстройствами питания, а также у взрослых с хроническими желудочно-кишечными заболеваниями.
Фермент обнаружен у африканского шёлкового червя (Anaphe venata)[4] и в ряде растений, например в папоротнике орляк, хвоще болотном (Тип I)[5][6].
Тиаминаза как причина развития дефицита витамина B1
[править | править код]Участие тиаминазы в развитии дефицита витамина B1 было выявлено при изучении ряда энзоотий и эндемий, возникающих без какой-либо эпизоотологической и эпидемиологической связи между предыдущими заболеваниями людей, животных и рыб:
- Авитаминоз B1 был выявлен при обследовании жителей Таиланда, которые в больших количествах использует в питании рыбу в сыром виде[7];
- Наблюдалась и экспериментально подтверждалась болезнь и гибель рыб (в основном от авитаминоза B1) под воздействием токсинов сине-зелёных водорослей, содержащих тиаминазу. Приём в пищу больной рыбы — одна из версий проявления гаффской болезни;
- Признаки заболеваний, обусловленных недостатком тиамина, были обнаружены в звероводческих хозяйствах после включения в рацион лисиц сырого карпа[8].
Тиаминаза разрушается при нагревании, но при этом её типы различаются по термостойкости. Термическая обработка продуктов, содержащих тиаминазу, позволяет применять их в пищу, не опасаясь развития дефицита тиамина. Австралийские аборигены длительно вымачивают богатые тиаминазой марсилию, прежде чем приготовить из неё суп или традиционные лепёшки «нарду», так как при термической обработке папоротниковых тиаминаза в них полностью не разрушается.
Животные, страдающие от дефицита тиамина из-за употребления в пищу тиаминазы, хорошо поддаются лечению на ранних стадиях заболевания. Внутримышечных инъекций тиамина и удаление источника тиаминазы из рациона животного, как правило, достаточно для их полного выздоровления[1].
Тиаминаза относительно широко распространена в природе, что свидетельствует о существенной роли фермента в поддержании клеточного метаболизма, несмотря на негативное влияние фермента. Фермент разлагает витамин B1 в организме, но не расщепляет тиольные производные тиамина. Поскольку тиольная форма под действием кислоты снова образует тиамин, то при некритичном превышении уровня тиаминазы это создает возможность сохранения тиамина в количестве необходимом организму[9].
Примечания
[править | править код]- ↑ 1 2 Department of Animal Science. THIAMINASES. Cornell University (9 октября 2015). Дата обращения: 1 июня 2016. Архивировано 17 июня 2016 года.
- ↑ Донченко Л.В., Надыкта В.Д. Безопасность пищевой продукции (Учебник. — 2-е изд.). — М.: ДеЛи принт, 2007. — 539 с. — ISBN 978-5-94343-092-3.
- ↑ Нечаев А.П., Траубенберг С.Е., Кочеткова А.А. и др. Пищевая химия. — СПб.: ГИОРД, 2007. — 640 с. — ISBN 5-98879-011-9.
- ↑ Nishimune T., Watanabe Y., Okazaki H, Akai H. Thiamin is decomposed due to Anaphe spp. entomophagy in seasonal ataxia patients in Nigeria // J. Nutr. — 2000. — № 130. — С. 1625–28.
- ↑ Barry V. McCleary, Bruce F. Chick. The purification and properties of a thiaminaseI from Nardoo (Marsilea drummondii) (англ.) // Phytochemistry : Журнал. — 1977. — No. 16. — P. 207-213. — doi:10.1016/S0031-9422(00)86787-4.
- ↑ Отравление растениями, содержащие фермент тиаминазу. veterinarua.ru. Дата обращения: 1 июня 2016. Архивировано 23 апреля 2016 года.
- ↑ В. М. АБАКУМОВ кмн. Антивитамины // Здоровье : Журнал. — 1980. — № 2. — С. 78/11. — ISSN 0044-1945. Архивировано 12 октября 2016 года.
- ↑ С.Ю. Штрыголь. Антивитамины. Антагонисты витамина В1 и подходы к коррекции их патогенного действия // Охорона здоров'я. — 2011. — Квитень (№ 7 (260)). — С. 55-57.
- ↑ Г.А. Мелентьева. Фармацевтическая химия. — Книга по требованию. — М. — С. 398. — 479 с. Архивировано 9 августа 2016 года.