Полиаминокарбоновые кислоты (HklngbnuktgjQkukfdy tnvlkmd)
Перейти к навигации
Перейти к поиску
Полиаминокарбоновые кислоты (комплексоны) — молекулы, в которых с атомом азота связано несколько алкилкарбоксильных групп —СН2СООН, способных одновременно связывать центральный атом комплекса несколькими координационными связями. Комплексоны образуют прочные, растворимые в воде соединения с большинством катионов.
Примеры
[править | править код]Наиболее простым представителем комплексонов является аминокислота глицин, H2NCH2COOH. В молекуле глицина аминогруппа NH2 отделена от карбоксильной группы COOH единственной метиленовой группой CH2. Когда карбоксильная группа депротонирована, ион глицина может являться бидентатным лигандом и образовывать хелатные комплексы с ионами металлов[1].
Другие примеры комплексонов[2]:
- Тридентатные — иминодиуксусная кислота
- Тетрадентатные — нитрилуксусная, нитрилтриметиленфосфоновая кислоты
- Пентадентатные — N-этилэтилендиамин-N,N',N'-триуксусная кислота
- Гексадентатные — этилендиаминтетрауксусная, о-фенилендиаминтетрауксусная, о-фенилендиамин-N,N-бис(диметиленфосфоновая) кислоты
- Гептадентатные — 2-гидрокси-1,3-диаминопропилен-N,N,N',N'-тетрауксусная кислота
- Октадентатные — диэтилентриаминпентауксусная кислота
 |
 |
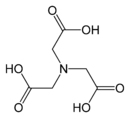 |
| Fura-2 | иминодиуксусная кислота[3] | нитрилотриуксусная кислота[4] |

|

|

|
| EDTA | DTPA[3] | EGTA |
Примечания
[править | править код]- ↑ Schwarzenbach, G. Der Chelateffekt (англ.) // Helv. Chim. Acta[англ.] : journal. — 1952. — Vol. 35. — P. 2344—2359. — doi:10.1002/hlca.19520350721.
- ↑ Основы аналитической химии, 2004.
- ↑ 1 2 Anderegg, G.; Arnaud-Neu, F.; Delgado, R.; Felcman, J.; Popov, K. Critical evaluation of stability constants of metal complexes of complexones for biomedical and environmental applications* (IUPAC Technical Report) (англ.) // Pure Appl. Chem., : journal. — 2005. — Vol. 77, no. 8. — P. 1445—1495. — doi:10.1351/pac200577081445. pdf Архивная копия от 26 июля 2011 на Wayback Machine
- ↑ Anderegg, G. Critical survey of stability constants of NTA complexes (англ.) // Pure Appl. Chem., : journal. — 1982. — Vol. 54, no. 12. — P. 2693—2758. — doi:10.1351/pac198254122693. pdf Архивная копия от 26 июля 2011 на Wayback Machine
Литература
[править | править код]- Основы аналитической химии / под ред. Ю. А. Золотова. — 3-е , перераб. и доп. — М.: Высш. шк., 2004. — Т. 2. — 503 с. — (Классический университетский учебник).
Это заготовка статьи по химии. Помогите Википедии, дополнив её. |
В статье не хватает ссылок на источники (см. рекомендации по поиску). |