Нитрат хрома(III) (Unmjgm ]jkbg(III))
| Нитрат хрома(III) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Нитрат хрома(III) |
| Хим. формула | Cr(NO3)3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 238,011 г/моль |
| Плотность | 1,85 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 60,06 °C |
| • разложения | 125 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 81 г/100 мл |
| Классификация | |
| Рег. номер CAS | 13548-38-4 |
| PubChem | 24598 |
| Рег. номер EINECS | 236-921-1 |
| SMILES | |
| InChI | |
| RTECS | GB6300000 |
| ChEBI | 86204 |
| Номер ООН | 2720 |
| ChemSpider | 23000 |
| Безопасность | |
| ЛД50 | 3250 мг/кг |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
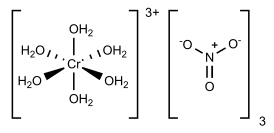
Нитрат хрома(III) — неорганическое вещество, соль металла хрома и азотной кислоты с формулой Cr(NO3)3, в безводном состоянии кристаллическое вещество зелёного цвета, образует несколько кристаллогидратов, самый устойчивый из которых нонагидрат [Cr(H2O)6](NO3)3•3H2O.
Получение
[править | править код]- Взаимодействием азотной кислоты с оксидом и гидроксидом хрома(III):
- Обменными реакциями:
- Безводный нитрат хрома(III) получают сушкой кристаллогидрата:
- В промышленности нитрат хрома(III) получают реакцией гидроксида хрома с азотной кислотой.
Физические свойства
[править | править код]Нитрат хрома(III) в безводном состоянии представляет собой зелёный гигроскопичный порошок, который разлагается при 125°С. Образует несколько кристаллогидратов, наиболее изученный из которых -- нонагидрат [Cr(H2O)6](NO3)3•3H2O, который при стандартных условиях является кристаллическим веществом пурпурного или тёмно-фиолетового цвета. Шесть молекул воды сконцентрированы вокруг атома хрома, остальные три молекулы располагаются в кристаллической решетке.
Нитрат, как и его нонанагидрат, хорошо растворяется в воде, а также этаноле и ацетоне.
Химические свойства
[править | править код]- При нагревании выше температуры плавления разлагается:
Применение
[править | править код]- Используется в качестве протравы для крашения тканей в текстильной промышленности;
- Используется как компонент катализатора для получения щелочных металлов;
- Используется для получения различных комплексов хрома(III).
Литература
[править | править код]- Третьяков Ю. Д. и др. Неорганическая химия. Химия элементов. Том 1. — 2-е изд., испр. — М.: Издательство Московского Университета, 2007. — 333 с.




_{3}\cdot 3H_{2}O\ {\xrightarrow {100^{o}C}}\ Cr(NO_{3})_{3}+9H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5bc4d363054f4affa6c673f4389fc8c99b736d6c)
