Карбид кальция (TgjQn; tgl,enx)
| Карбид кальция | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
Кальция карбид | ||
| Сокращения | CaC2 | ||
| Традиционные названия | Ацетиленид кальция; углеродистый кальций | ||
| Хим. формула | CaC2 | ||
| Рац. формула | CaC2 | ||
| Физические свойства | |||
| Состояние | твёрдое | ||
| Молярная масса | 64,0994 (±0,004) г/моль | ||
| Плотность | 2,22 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 2160 °C | ||
| • кипения | 2300 °C | ||
| Энтальпия | |||
| • образования | -62,8 кДж/моль | ||
| Структура | |||
| Координационная геометрия | 6 | ||
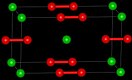
| Кристаллическая структура | Тетрагональная | ||
| Классификация | |||
| Рег. номер CAS | 75-20-7 | ||
| PubChem | 6352 | ||
| Рег. номер EINECS | 200-848-3 | ||
| SMILES | |||
| InChI | |||
| RTECS | EV9400000 | ||
| Номер ООН | 1402 | ||
| ChemSpider | 6112 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Карби́д ка́льция (углеро́дистый ка́льций, ацетилени́д кальция) — — в чистом виде бесцветные кристаллы. Бинарное неорганическое соединение кальция с углеродом.
История получения
[править | править код]Впервые получен в 1862 году Фридрихом Вёлером нагреванием сплава цинка и кальция с углём[источник не указан 807 дней].
Получение
[править | править код]В разделе не хватает ссылок на источники (см. рекомендации по поиску). |
В настоящее время получают прокаливанием в электрических печах (температура 1900—1950 °C) смеси оксида кальция с коксом.
- .
Полученный таким образом технический продукт имеет серый, коричневый или зеленоватый цвет вследствие загрязнения углём и другими примесями. Он содержит также примеси фосфида и сульфида кальция, поэтому такой карбид кальция и полученный из него ацетилен имеют неприятный запах из-за образования фосфина и сероводорода.
Физические свойства
[править | править код]- Бесцветные тетрагональные кристаллы.
- Плотность: 2,2 г/см3 (при 20 °C).
- Удельная теплоёмкость при постоянном давлении: 0,92 Дж/г·K (в диапазоне 20—325 °C).
- Стандартная мольная теплоёмкость Cp (при 298 К, твёрдый): 62,34 Дж/моль.
- Стандартная энтальпия образования ΔfH (твёрдый, при 298 К): −62,8 кДж/моль.
- Стандартная энергия образования Гиббса ΔfG (твёрдый, при 298 К): −67,8 кДж/моль.
- Стандартная энтропия образования S (при 298 К, твёрдый): 70,3 Дж/моль·K.
- Энтальпия плавления ΔHпл: 32,2 кДж/моль.
- Технический карбид кальция имеет резкий чесночный запах от примеси фосфина в ацетилене при взаимодействии с влагой воздуха[источник не указан 807 дней].
Химические свойства
[править | править код]При взаимодействии c водой карбид кальция гидролизуется с образованием ацетилена и гидроксида кальция (гашёной извести)[2]:
- .
Эта реакция является экзотермической и протекает очень бурно, возможны самовозгорание ацетилена и взрыв. При нарушении правил техники безопасности возможно получение травм и ожогов.
Карбид кальция способен связывать азот при 1000 °C. На этой реакции основан цианамидный метод связывания азота:
- .
Внешний вид и характеристики технического карбида кальция
[править | править код]Предположительно, эта страница или раздел нарушает авторские права. |
Карбид кальция получают сплавлением в электрических печах кокса и негашеной извести. Расплавленный карбид кальция выпускается из печи в специальные формы — изложницы, в которых он затвердевает. Застывший карбид кальция дробится и сортируется на куски определённых размеров.
Технический карбид кальция представляет собой твёрдое кристаллическое вещество тёмно-серого или коричневого цвета. Он даёт кристаллический излом серого цвета с различными оттенками в зависимости от чистоты. Карбид кальция гигроскопичен, то есть поглощает воду. При взаимодействии с водой даже на холоде карбид кальция разлагается с бурным выделением ацетилена и большого количества тепла. Из за содержания примесей при добавлении воды выделяется неприятный запах. Разложение карбида кальция происходит и под влиянием атмосферной влаги.
По ГОСТ 1460-56 установлены следующие размеры (грануляция) кусков товарного карбида кальция: 2×8; 8×15; 15×25; 25×80. Технический карбид кальция содержит до 80 % химически чистого карбида кальция, остальное составляют примеси — негашеная известь, углерод, кремнезём и другие вещества[3].
Применение
[править | править код]Предположительно, эта страница или раздел нарушает авторские права. |
Карбид кальция используют при проведении автогенных работ и освещения (карбидная лампа), а также в производстве ацетиленовой сажи и продуктов органического синтеза, из которых главным является синтетический каучук.
Карбид кальция применяют в производстве цианамида кальция, из которого получают удобрения, цианистые соединения.
Карбид кальция используют для получения карбидно-карбамидного регулятора роста растений, изготовления порошкового карбидного реагента.
Из 1 кг технического карбида получается от 235 до 285 л ацетилена в зависимости от его сорта и грануляции: чем чище и крупнее карбид кальция, тем большее количество ацетилена он даёт при разложении.
Для разложения 1 кг карбида кальция теоретически требуется 0,56 л воды. Практически берут от 5 до 20 л воды для лучшего охлаждения ацетилена и обеспечения безопасности при работе. Скорость разложения карбида кальция водой зависит от его чистоты, грануляции, температуры и чистоты воды. Чем чище карбид кальция, меньше размер его кусков, выше температура и чище вода, тем больше скорость[3].
Физиологическое действие
[править | править код]В разделе не хватает ссылок на источники (см. рекомендации по поиску). |
- Среди всех неорганических производных кальция самый ядовитый.
- По степени воздействия на организм человека карбид кальция относится к 1-му классу опасности согласно ГОСТ 12.1.007.
- Попадание карбида кальция внутрь организма также является опасным.
- Пыль карбида кальция оказывает раздражающее действие на кожу, слизистые оболочки органов дыхания.
См. также
[править | править код]Примечания
[править | править код]- ↑ Кальция карбид: химические и физические свойства. Дата обращения: 12 июня 2015. Архивировано 16 июня 2015 года.
- ↑ Кальция карбид:справочник химика. Дата обращения: 12 июня 2015. Архивировано 14 июня 2015 года.
- ↑ 1 2 Использование и применение карбида кальция. Архивировано из оригинала 15 июня 2015 года.
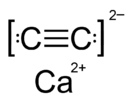


![{\displaystyle {\ce {CaO\ +3C->[1900-1950~^{\circ }{\text{C}}]CaC2\ +CO}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/79d240936b46ec242b7c26ee78bd20f1900e9094)

