Индекс репродукции (Nu;ytv jyhjk;rtenn)
И́ндекс репроду́кции[1] (, в медицинской литературе часто базовое репродуктивное число[2]; также базовый показатель репродукции[3], базовая скорость репродукции[4], основное репродуктивное число[5] и др.) — безразмерный параметр, характеризующий заразность инфекционного заболевания в медицинской и ветеринарной эпидемиологии. Обычно определяется как количество индивидуумов, которые будут заражены типичным[6] заболевшим, попавшим в полностью неиммунизированное окружение при отсутствии специальных эпидемиологических мер, направленных на предотвращение распространения заболевания (например, карантина)[7]. Если то на начальном этапе число заболевших будет расти экспоненциально.
Величина для крайне заразных заболеваний — около 10 (корь — 11…15, ветрянка — 7…12, свинка — 11…14)[8]. Использование иммунизации понижает заразность заболевания, этот факт отражается так называемым эффективным репродуктивным числом где — доля иммунизированных в населении. В простой модели доля иммунного населения, которая останавливает экспоненциальный рост числа заражённых, равна Поскольку эффективность вакцины[англ.] не стопроцентна, охват вакцинации, необходимый для предотвращения вспышек () крайне заразных заболеваний, должен быть очень высок (96…99 %)[9]. В случае менее заразных заболеваний нужная для остановки эпидемии доля иммунного населения ниже: например, при эта доля ниже 29 % и, если иммунитет сохраняется после выздоровления, распространение болезни прекратится после достижения этого процента выздоровевших.
невозможно замерить напрямую, его вычисленная величина зависит от избранной модели механизма заражения. Ли, Блейкли и Смит[10] демонстрируют, как одни и те же данные могут дать существенные различия в при использовании разных моделей и приводят обзор альтернатив для характеризации заразности. В случае сезонных заболеваний количество заражённых варьирует с временем года и потому фиксированное значение неприменимо[11].
Типичные значения
[править | править код]| Заболевание | Способ передачи | R0 |
|---|---|---|
| Корь | воздушный | 12-18[13] |
| Ветряная оспа | воздушный | 10-12[14] |
| Эпидемический паротит | воздушно-капельный | 10-12[15] |
| Полиомиелит | фекально-оральный[англ.] | 5-7 |
| Краснуха | воздушно-капельный | 5-7 |
| Коклюш | воздушно-капельный | 5,5[16] |
| Натуральная оспа | воздушно-капельный | 3,5-6[17] |
| COVID-19
(уханьский штамм) |
воздушно-капельный | 1,4-5,7[18][19][20][21] |
| Синдром приобретённого иммунного дефицита | жидкости тела | 2-5 |
| Тяжёлый острый респираторный синдром | воздушно-капельный | 2-5[22] |
| Простуда | воздушно-капельный | 2-3[23] |
| Дифтерия | слюна | 1,7-4,3[24] |
| Грипп (пандемия 1918 года) |
воздушно-капельный | 1,4-2,8[25] |
| Эбола (эпидемия лихорадки Эбола в Западной Африке) |
жидкости тела | 1,5-1,9[26] |
| Грипп (пандемия 2009 года) |
воздушно-капельный | 1,4-1,6[27] |
| Грипп (сезонные вариации) |
воздушно-капельный | 0,9-2,1[27] |
| Ближневосточный респираторный синдром | воздушно-капельный | 0,3-0,8[28] |
История
[править | править код]Корни базовой концепции репродукции прослеживаются в работах Рональда Росса, Альфреда Лотки и других[29], но её первое современное применение в эпидемиологии было сделано Джорджем Макдональдом в 1952 году[30], который создал популяционные модели распространения малярии. В своей работе он ввёл числовой показатель скорости репродукции и обозначил его как Z0.
Определения в конкретных случаях
[править | править код]Связь с частотой контактов и периодом инфекции
[править | править код]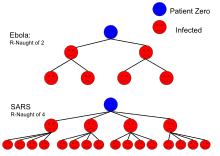
Предположим, что заразные люди в среднем создают заражающих контактов в единицу времени, со средним инфекционным периодом . Тогда индекс репродукции:
Эта простая формула предлагает различные способы уменьшения R0 и распространения инфекции. Можно уменьшить количество инфекционных контактов в единицу времени путём уменьшения количества контактов в единицу времени (например, оставаясь дома, если заражение требует контакта с другими людьми для распространения) или применения средств, затрудняющих передачу инфекции (например, ношение какого-либо защитного оборудования). Также можно уменьшить инфекционный период путём выявления, а затем изоляции, лечения или устранения (как это часто бывает с животными) инфекционных индивидуумов в кратчайшие возможные сроки.
Связь со скрытыми периодами
[править | править код]Латентный период — это время перехода от случая заражения к проявлению заболевания. В случаях заболеваний с различными латентными периодами индекс размножения может быть рассчитан как сумма индексов репродукции для каждого случая перехода в заболевание. Примером этого является туберкулез. Бловер и соавторы рассчитывают следующий индекс репродукции[31]:
В их модели предполагается, что у инфицированных людей может развиться активный туберкулез путем прямого прогрессирования (заболевание развивается сразу после заражения), рассматриваемого выше как БЫСТРЫЙ туберкулез, или эндогенной реактивации (заболевание развивается спустя годы после заражения), рассматриваемого выше как МЕДЛЕННЫЙ туберкулез[32].
Гетерогенные популяции
[править | править код]В популяциях, которые не являются однородными, определение R0 является более тонким. Определение должно учитывать тот факт, что типичный заразный человек не может быть средним человеком. Для отдельных общностей всего населения характерно явление суперраспространительства. Так, при среднем индексе репродукции для Covid-19 равном приблизительно 2,5—3, в Республике Корее пожилая сектантка, со слабыми симптомами, вопреки совету своего врача являлась на религиозные службы и в итоге заразила более ста человек[33]. По некоторым оценкам, распространение инфекции во многом проходит в соответствии с правилом Парето 20/80[34] когда около 20 % инфицированных отвечают за 80 % заражений[35]. Если вероятность заражения на ранних стадиях эпидемии отличается от вероятности на поздних стадиях, то вычисление R0 должно учитывать эту разницу. Подходящим определением для R0 в этом случае является «ожидаемое количество вторичных случаев, вызванных типичным инфицированным человеком в начале эпидемии»[36].
Методы оценки
[править | править код]Во время эпидемии, как правило, известно число диагностированных инфекций с течением времени . На ранних стадиях эпидемии рост является экспоненциальным с логарифмической скоростью роста.
Для экспоненциального роста можно интерпретировать как совокупное число диагнозов (включая выздоровевших людей) или текущее число диагностированных пациентов; логарифмическая скорость роста одинакова для любого определения. Чтобы оценить необходимы предположения о временной задержке между заражением и диагностикой и временем между заражением и началом заразности.
При экспоненциальном росте связано с временем удвоения[англ.] как
- .
Простая модель
[править | править код]Если человек после заражения заражает новых индивидуумов по прошествии определённого времени , то число подверженных (не выздоровевших) индивидуумов с течением времени составляет
В этом случае
- или
Например, если д и д−1, получим
Скрытый инфекционный период, изоляция после диагностики
[править | править код]В этой модели отдельное инфицирование имеет следующие стадии:
- Инфицированный незаразный: человек инфицирован, но не имеет симптомов и ещё не заражает других. Средняя продолжительность этого состояния
- Скрытая (бессимптомный): человек инфицирован, не имеет симптомов, но заражает других. Средняя продолжительность скрытого инфицированного состояния составляет . Человек заражает других людей в течение этого периода. Следует отметить, что бессимптомный инфицированный может остаться в этом состоянии до конца времени заразности, но также перейти в симптомное состояние, то есть находиться в предсимптомном состоянии.
- Изоляция[англ.] после постановки диагноза: принимаются меры для предотвращения дальнейших инфекций, например, путем изоляции пациента.
В терминах модели SEIR R0 может быть записано в следующей форме[37]:
Это следует из дифференциального уравнения для числа инфицированных незаразных лиц и количества скрытых инфицированных людей ,
Для такой модели логарифмическая скорость роста эпидемического процесса является функцией от и равна максимальному собственному значению матрицы. Этот метод оценки был применён к COVID-19 и SARS.
В особом случаев эта модель приводит к который отличается от простой модели выше Например, с одинаковыми значениями д и д−1 получим а не Разница обусловлена тонкой разницей в базовой модели роста; вышеприведённое матричное уравнение предполагает, что вновь заражённые пациенты могут начать передавать заболевание непосредственно после заражения; время — это среднее время. Это различие показывает, что оценочное значение числа воспроизведения зависит от базовой математической модели; если число репродукции оценивается по конкретной модели, эту же модель следует использовать для прогнозов на будущее.
См. также
[править | править код]Примечания
[править | править код]- ↑ Сергеева И. В., Демко И. В. Особенности течения гриппа и вирусно-бактериальных пневмоний (по материалам многопрофильных стационаров г. Красноярска). — М.: Издательский дом Академии Естествознания, 2017. — 179 с. — ISBN 978-8-91327-476-2.
- ↑ Баринова А. Н. Понятие о группах риска инфекций, передающихся половым путем, и ВИЧ-инфекции. Обзор литературы // Российский семейный врач. — 2012. — Вып. 1.
- ↑ https://www.vetpress.ru/jour/article/viewFile/937/921
- ↑ Коренной Ф. И., Гуленкин В. М., Караулов А. К. АФРИКАНСКАЯ ЧУМА СВИНЕЙ У ДИКИХ КАБАНОВ НА ТЕРРИТОРИИ РОССИЙСКОЙ ФЕДЕРАЦИИ: К ВОПРОСУ О РЕГУЛИРОВАНИИ ЧИСЛЕННОСТИ // Актуальные вопросы ветеринарной биологии. — 2016. — Вып. 1 (29). — С. 29—37.

- ↑ Динамические системы и модели в биологии - Александр Братусь, Артем Новожилов, Андрей Платонов - Google Книги
- ↑ Дикман, 1990.
- ↑ The reproduction number Архивная копия от 1 февраля 2020 на Wayback Machine. Department of Health. Australian Government.
- ↑ (англ.)Keeling M. J., Grenfell B. T. Individual-based perspectives on R0 (англ.) // Journal of theoretical biology. — 2000. — Vol. 203, iss. 1. — P. 51—61. — doi:10.1006/jtbi.1999.106. Архивировано 3 августа 2021 года.

- ↑ (англ.)Rubió P. P. Is the basic reproductive number (R0) for measles viruses observed in recent outbreaks lower than in the pre-vaccination era? (англ.) // Eurosurveillance. — 2012. — Vol. 17, iss. 31. — P. 20233.

- ↑ Ли, 2011.
- ↑ Грассли, 2006.
- ↑ Если не указано иное, значения R0 взяты из History and Epidemiology of Global Smallpox Eradication (Архивировано 10 мая 2016 года.), модуль учебного курса «Smallpox: Disease, Prevention, and Intervention». The CDC and the WHO, 2001. Slide 17. Источники указаны как «Modified from Epid Rev 1993;15: 265—302, Am J Prev Med 2001; 20 (4S): 88-153, MMWR 2000; 49 (SS-9); 27-38».
- ↑ Guerra, Fiona M.; Bolotin, Shelly; Lim, Gillian; Heffernan, Jane; Deeks, Shelley L.; Li, Ye; Crowcroft, Natasha S. The basic reproduction number (R0) of measles: a systematic review (англ.) // The Lancet Infectious Diseases : journal. — Elsevier, 2017. — 1 December (vol. 17, no. 12). — P. e420–e428. — ISSN 1473-3099. — doi:10.1016/S1473-3099(17)30307-9. Архивировано 10 апреля 2020 года.
- ↑ Ireland's Health Services. Health Care Worker Information. Архивировано 26 марта 2020 года.
- ↑ Australian government Department of Health Архивная копия от 18 августа 2020 на Wayback Machine Mumps Laboratory Case Definition (LCD)
- ↑ Kretzschmar M., Teunis P. F., Pebody R. G. Incidence and reproduction numbers of pertussis: estimates from serological and social contact data in five European countries (англ.) // PLOS Med.. — 2010. — Vol. 7, iss. 6. — P. e1000291. — doi:10.1371/journal.pmed.1000291. — PMID 20585374.
- ↑ Gani R., Leach S. Transmission potential of smallpox in contemporary populations (англ.) // Nature. — 2001. — Vol. 414, no. 6865. — P. 748—751. — ISSN 1476-4687. — doi:10.1038/414748a. Архивировано 10 июня 2020 года.
- ↑ Li Q. et al. Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus-Infected Pneumonia (англ.) // The New England Journal of Medicine. — 2020. — doi:10.1056/NEJMoa2001316. — PMID 31995857.
- ↑ Riou J., Althaus C. L. Pattern of early human-to-human transmission of Wuhan 2019 novel coronavirus (2019-nCoV), December 2019 to January 2020 (англ.) // Eurosurveillance[англ.]. — 2020. — Vol. 25, no. 4. — doi:10.2807/1560-7917.ES.2020.25.4.2000058. — PMID 32019669.
- ↑ Wu J. T. et al. Estimating clinical severity of COVID-19 from the transmission dynamics in Wuhan, China (англ.) // Nature Medicine. — 2020. — Vol. 26. — P. 506—510. — ISSN 1546-170X. — doi:10.1038/s41591-020-0822-7. Архивировано 2 апреля 2020 года.
- ↑ Sanche S. et al. High Contagiousness and Rapid Spread of Severe Acute Respiratory Syndrome Coronavirus 2 (англ.) // Emerging Infectious Diseases[англ.]. — Centers for Disease Control and Prevention, 2020. — Vol. 26, no. 7. — P. 1470—1477. — doi:10.3201/eid2607.200282. Архивировано 10 апреля 2020 года.
- ↑ Wallinga J., Teunis P. Different epidemic curves for severe acute respiratory syndrome reveal similar impacts of control measures (англ.) // Am. J. Epidemiol.[англ.]. — 2004. — Vol. 160, no. 6. — P. 509—516. — doi:10.1093/aje/kwh255. — PMID 15353409. Архивировано 6 октября 2007 года.
- ↑ Magic formula that will determine whether Ebola is beaten. The Telegraph. Telegraph.Co.Uk. Дата обращения: 30 марта 2020. Архивировано 7 ноября 2014 года.
- ↑ Truelove S. A. et al. Clinical and Epidemiological Aspects of Diphtheria: A Systematic Review and Pooled Analysis (англ.) // Clinical Infectious Diseases[англ.]. — 2020. — Vol. 71. — P. 89–97. — doi:10.1093/cid/ciz808. Архивировано 18 апреля 2020 года.
- ↑ Ferguson N. M. et al. Strategies for mitigating an influenza pandemic (англ.) // Nature. — 2006. — Vol. 442, no. 7101. — P. 448—452. — doi:10.1038/nature04795. — PMID 16642006.
- ↑ Khan A., Naveed M., Dur-e-Ahmad M., Imran M. Estimating the basic reproductive ratio for the Ebola outbreak in Liberia and Sierra Leone (англ.) // Infectious Diseases of Poverty. — 2015. — 24 February (vol. 4). — doi:10.1186/s40249-015-0043-3. — PMID 25737782. — PMC 4347917. Архивировано 29 июня 2021 года.

- ↑ 1 2 Coburn B. J., Wagner B. G., Blower S. Modeling influenza epidemics and pandemics: insights into the future of swine flu (H1N1) (англ.) // BMC Medicine[англ.]. — 2009. — Vol. 7. — P. Article 30. — doi:10.1186/1741-7015-7-30. — PMID 19545404.

- ↑ Kucharski A., Althaus C. L. The role of superspreading in Middle East respiratory syndrome coronavirus (MERS-CoV) transmission (англ.) // Eurosurveillance[англ.]. — 2015. — Vol. 20, no. 26. — P. 14—18. — doi:10.2807/1560-7917.ES2015.20.25.21167. — PMID 26132768. Архивировано 19 июля 2021 года.

- ↑ Smith D. L. et al. Ross, Macdonald, and a Theory for the Dynamics and Control of Mosquito-Transmitted Pathogens (англ.) // PLOS Pathogens. — 2012. — 5 April (vol. 8, no. 4). — P. e1002588. — ISSN 1553-7366. — doi:10.1371/journal.ppat.1002588. — PMID 22496640. — PMC 3320609.
- ↑ Macdonald G. The analysis of equilibrium in malaria // Tropical Diseases Bulletin. — 1952. — Сентябрь (т. 49, № 9). — С. 813—829. — ISSN 0041-3240. — PMID 12995455.
- ↑ Blower S. M. et al. The intrinsic transmission dynamics of tuberculosis epidemics (англ.) // Nature Medicine. — 1995. — Vol. 1. — P. 815—821. — doi:10.1038/nm0895-815.
- ↑ Ma Y., Horsburgh C. R., White L. F., Jenkins H. E. Quantifying TB transmission: a systematic review of reproduction number and serial interval estimates for tuberculosis (англ.) // Epidemiol Infect.. — 2018. — Vol. 146, no. 12. — doi:10.1017/S0950268818001760. — PMID 29970199. Архивировано 18 ноября 2020 года.
- ↑ Barr, Gerald D. The Covid-19 Crisis and the need for suitable face masks for the general population // Chinese J Med Res 3 (2020): 28-31. (англ.)
- ↑ Galvani, Alison P. Epidemiology: Dimensions of superspreading (англ.) // Nature. — 2005. — Vol. 438, no. 7066. — P. 293—295. — doi:10.1038/438293a. — . — PMID 16292292.
- ↑ Lloyd-Smith, J. O. Superspreading and the effect of individual variation on disease emergence (англ.) // Nature : journal. — 2005. — Vol. 438, no. 7066. — P. 355—359. — doi:10.1038/nature04153. — . — PMID 16292310. Архивировано 21 мая 2020 года.
- ↑ O Diekmann; J.A.P. Heesterbeek; J.A.J. Metz. On the definition and the computation of the basic reproduction ratio R0 in models for infectious diseases in heterogeneous populations (англ.) // Journal of Mathematical Biology[англ.] : journal. — 1990. — Vol. 28, no. 4. — P. 356—382. — doi:10.1007/BF00178324. — PMID 2117040.
- ↑ Lipsitch М. et al. Transmission Dynamics and Control of Severe Acute Respiratory Syndrome (англ.) // Science. — 2003. — Vol. 300, no. 5627. — P. 1966—1970. — ISSN 0036-8075. — doi:10.1126/science.1086616. — . — PMID 12766207. — PMC 2760158.
Литература
[править | править код]- Nicholas C Grassly, Christophe Fraser. Seasonal infectious disease epidemiology (англ.) // Proc Biol Sci. — 2006. — 1 October (iss. 273, no. 1600). — P. 2541—2550. — doi:10.1098/rspb.2006.3604.
- Diekmann, O., Heesterbeek, J.A.P., Metz, Johan. On the Definition and the Computation of the Basic Reproduction Ratio R0 in Models For Infectious-Diseases in Heterogeneous Populations (англ.) // Journal of mathematical biology. — 1990. — February (vol. 28). — P. 365—382. — doi:10.1007/BF00178324.
- Jing Li, Daniel Blakeley, Robert J. Smith?. The failure of 𝑅0 (англ.) // Computational and mathematical methods in medicine. — 2011.




































