Дисиамилборан (:nvngbnlQkjgu)
| Дисиамилборан | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Бис-(1,2-диметилпропил)боран |
| Сокращения | DSB |
| Традиционные названия | Дисиамилборан, B(Sia)2H |
| Хим. формула | BC10H23 |
| Рац. формула | B(C5H11)2H, B(Sia)2H |
| Физические свойства | |
| Состояние | Твёрдое |
| Молярная масса | 154.100616455 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | -17 °C |
| • кипения | 185 °C |
| • вспышки | 65,7 °C |
| Давление пара | 0,975 Торр при 25 °C |
| Классификация | |
| Рег. номер CAS | 1069-54-1 |
| PubChem | 6337887 |
| SMILES | |
| InChI | |
| ChemSpider | 167251 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Дисиамилборан — бороорганическое соединение с формулой B(C5H11)2H. Дисиамилборан обладает способностью гидроборировать алкены и алкины, на чём и основано его применение в органическом синтезе.
История исследования
[править | править код]Дисиамилборан был исследован Гербертом Брауном вместе с другими замещёнными боранами в 1958 году, за что он в 1979 году получил нобелевскую премию («за разработку новых методов органического синтеза сложных бор- и фосфорсодержащих соединений»). Вместе с дисиамилбораном Браун изучал также такие замещённые бораны, как тексилборан, 9-борабициклононан и диизопинокамфеилборан.
Получение
[править | править код]Дисиамилборан получают взаимодействием диборана с триметлэтиленом в тетрагидрофуране при комнатной температуре в инертной атмосфере (например, аргоне).
Применение
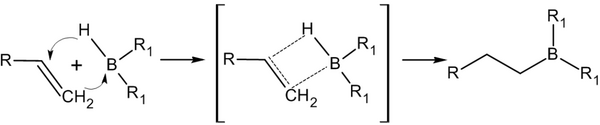
[править | править код]Дисиамилборан, как и другие бораны, присоединяется к кратной связи с промежуточным образованием мостикового бор-углеродного соединения с трёхцентровой двухэлектронной связью B-H-C, причём при этом образуется циклический активированный комплекс, в котором бор присоединяется к кратной связи против правила Марковникова — к более гидрированному атому углерода[1]:
В случае дисиамилборана R1 — сиамильный радикал, 1,2-диметилпропил.
Присоединение дисиамилборана к тройной связи происходит по аналогичному механизму, однако скорость присоединения дисиамилборана по тройной связи на несколько порядков выше. Дальнейшее присоединение дисиамилборана не идёт по стерическим причинам (углеводородные радикалы первой молекулы «мешают» присоединению второй). На этом основано лабораторное получение цис-алкенов сложного строения. Образующийся триалкилборан подвергают воздействию уксусной кислоты, в результате чего с выходом около 99 % образуется цис-изомер соответствующего алкена (происходит гидрирование алкин->цис-алкен)[2][3].
Если же вместо уксусной кислоты взять смесь пероксида и щёлочи, то из алкена образуется спирт со спиртогруппой у более гидрированного атома углерода, который невозможно получить по правилу Марковникова[1].
Дисиамилборан имеет ряд преимуществ по сравнению с другими боранами. С одной стороны, разветвлённые углеводородные радикалы достаточно снижают активность борана в реакциях нуклеофильного присоединения по кратной связи, а с другой стороны, дисиамилборан достаточно просто получить, в отличие от, например, диизопинокамфеилборана, получение которого связано с некоторыми трудностями.
Примечания
[править | править код]- ↑ 1 2 Курц А Л., Ливанцов М.В., Ливанцова Л.И. Гидроборирование алкенов. Алкены (Часть 2). ChemNet. Химический факультет МГУ (1998). Дата обращения: 2 сентября 2009. Архивировано из оригинала 19 декабря 2011 года.
- ↑ Алкены II. Гидроборирование алкено. Дата обращения: 21 декабря 2013. Архивировано из оригинала 19 декабря 2011 года.
- ↑ Леви В. Г. Общая органическая химия, т. 6