Глутаматдегидрогеназа (Ilrmgbgm;yin;jkiyug[g)
Глутаматдегидрогена́за, также L-глутамат: NAD-оксидоредуктаза (англ. Glutamate dehydrogenase, сокр. GLDH, GDH) — фермент (КФ 1.4.1.2), из семейства оксидоредуктаз аминокислот (класс оксидоредуктазы), катализирующий обратимую реакцию превращения L-глутаминовой кислоты в α-кетоглутаровую. Фермент присутствует как в прокариотических организмах, так и в эукариотических митохондриях.
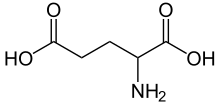
На стадии α-кетоглутаровой кислоты в цикле трикарбоновых кислот может иметь место выход этой кетокислоты из круга и превращение её в L-глутаминовую кислоту посредством аминирования за счёт свободного аммиака или обратимой реакции переаминирования.
Установлено, что небелковым компонентом является или НАД или же НАДФ.
Она является регуляторным ферментом аминокислотного обмена. Аллостерические ингибиторы – АТФ, ГТФ, НАД(Ф)Н. Высокие концентрации АДФ активируют фермент. Таким образом, низкий энергетический уровень в клетке стимулирует разрушение аминокислот и образование α-кетоглутарата, поступающего в ЦТК как энергетический субстрат. Глутаматдегидрогеназа может индуцироваться стероидными гормонами (кортизолом) и ингибироваться эстрогенами и тироксином[1].

Дегидрогеназе L-глутаминовой кислоты принадлежит большая роль в обмене не только белков, где глутаминовая кислота благодаря реакции переаминирования занимает ключевое значение, но также в обмене углеводов и жиров посредством образования или удаления путём аминирования α-кетоглутаровой кислоты. Она является единственной дегидрогеназой, катализирующей окислительное дезаминирование натуральных аминокислот L-конфигурации, действующей через пиридиновые нуклеотиды и обладающей активностью, достаточной для того, чтобы играть значительную биологическую роль.
Перекристализованный фермент наиболее устойчив в области pH 6,0-9,0 и может сохраняться в течение длительного времени в замороженном состоянии или в виде суспензии в растворе сульфата натрия.
Содержание в различных тканях
[править | править код]Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов, кроме мышц[1]. Фермент содержится прежде всего в печени, почках, нейронах и глиальных клетках и сердечной мышце. Малые количества фермента имеются также в скелетной мускулатуре, лейкоцитах. Присутствие дегидрогеназ L-глутаминовой кислоты установлено в дрожжах, микробах и высших растениях[2]. .
История открытия
[править | править код]Этот фермент открыл в 1920 году Тунберг в мышцах лягушки.
Это заготовка статьи по биохимии. Помогите Википедии, дополнив её. |
В статье не хватает ссылок на источники (см. рекомендации по поиску). |
- ↑ 1 2 зав. каф. биологической химии, проф. В. В. Лелевич; доц. И. О. Леднева; доц. Н. Э. Петушок; канд. мед. наук, доц. М. Н. Курбат; доц. В. В. Воробьев. Биологическая химия : учебное пособие для студентов учреждений высшего образования по медицинским специальностям. — Гродно, 2015. — 380 с. — ISBN 978-985-558-606-8.
- ↑ Prem Prakash, Narayan S. Punekar, and Prasenjit Bhaumik. Structural basis for the catalytic mechanism and -ketoglutarate cooperativity of glutamate dehydrogenaseJ. Biol. Chem. (2018) 293(17) 6241–6258