Ацетат кальция (Geymgm tgl,enx)
| Ацетат кальция | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
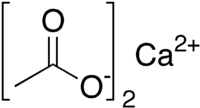
Ацетат кальция |
| Сокращения | Ca(OAc)2 |
| Традиционные названия | Пригорело-древесная соль[1] |
| Хим. формула | Ca(CH3COO)2 |
| Рац. формула | CaC4H6O4 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 158.138 г/моль |
| Плотность | 1.6 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 160 (с разложением)[2] |
| • разложения | 160 ± 1 °C[3] |
| Химические свойства | |
| Растворимость | |
| • в воде | 40 г/100 мл |
| Классификация | |
| Рег. номер CAS | 62-54-4 |
| PubChem | 6116 и 517040 |
| Рег. номер EINECS | 200-540-9 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E263 |
| RTECS | AF7525000 |
| ChEBI | 3310 |
| ChemSpider | 5890 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацетат кальция — кальциевая соль уксусной кислоты. Бесцветное кристаллическое или аморфное вещество, хорошо растворимое в воде. Технический моногидрат может быть в форме гранул или некрупных игл. Обладает слабым вкусом и запахом уксуса. Химическая формула — Ca(CH3COO)2, однако чаще получают его моногидрат Ca(CH3COO)2•H2O.[4]
История названия
[править | править код]Пригорело-древесная соль — старинное название ацетата кальция — в старину получалась при сухой перегонке древесины, из-за чего древесина, естественно, обугливалась, «пригорала». Из-за того, что метод сухой перегонки древесины использовался алхимиками с незапамятных времён[5], установить человека, давшего такое название этой соли или впервые получившего её, невозможно.
Получение
[править | править код]В лаборатории получают действием уксусной кислоты на карбонат, оксид или гидроксид кальция.[6]
- Также возможно получение из простого вещества:
Применение
[править | править код]Не имеет промышленного применения.
Используется в лаборатории для получения диметилкетона (ацетона). Эту реакцию осуществляют, нагревая ацетат кальция до 160 °С[2][7]:
Именно из-за этой реакции ацетат кальция нельзя хранить или сушить вблизи открытого огня, а помещения, в которых происходят работы с ацетатом кальция, должны быть оборудованы приточно-вытяжной вентиляцией.[8]
Также может применяться в лаборатории для получения сложных эфиров уксусной кислоты — алкилацетатов:
Также ацетат кальция используется для получения ацетата калия обменными реакциями из карбоната и/или бикарбоната калия:
Также ацетат кальция применяют при получении лавсана в качестве катализатора.[4]
Ещё одним способом применения ацетата кальция является приготовление аналога сухого спирта — твёрдого спиртового сольвата ацетата кальция — при смешивании ацетата кальция и этилового спирта.
Пищевая промышленность
[править | править код]Ацетат кальция зарегистрирован в пищевой промышленности в качестве пищевой добавки группы консервантов E263.[9] Может применяться как консервант, регулятор кислотности, уплотнитель растительных тканей. Останавливает развитие болезнетворных бактерий в хлебобулочных изделиях, смягчает ярко выраженный кислый вкус консервированных овощей и фруктов. В сельскохозяйственной промышленности используется для консервации кормов.[10] Так как действие ацетата кальция ограничено наличием в продуктах сульфатов, фосфатов, карбонатов и гидрокарбонатов, которые в конечном итоге дают осадки с катионом , то применять его лучше в сочетании с другими консервантами.
| Массовая доля основного вещества,безводная форма, %, не менее | 98 |
| Потери при просушке, %, не более | 11 |
| pH 10%-го водного раствора | 6-9 (включительно) |
| Массовая доля нерастворимых веществ, %, не более | 0,3 |
Медицина
[править | править код]Ацетат кальция оказывает абсорбирующее действие на анионы фосфорных кислот:
Также ацетат кальция восстанавливает положительный кальциевый баланс у больных с почечной недостаточностью в легкой, средней и тяжелой форме и у больных, находящихся на гемодиализе или перитонеальном диализе[11]. Является безалюминиевым и безмагниевым фосфат-связывающим препаратом (фосфат-биндером). Фосфат-связывающая способность ацетата кальция в 2 раза выше, а всасываемость его в кишечнике значительно меньше, чем у кальция карбоната.
Примечания
[править | править код]- ↑ ТРИВИАЛЬНЫЕ НАЗВАНИЯ ВЕЩЕСТВ. Дата обращения: 29 мая 2013. Архивировано 28 января 2012 года.
- ↑ 1 2 Ацетат кальция е263 (e263) | Пищевые добавки «НОРД». Архивировано 5 июня 2013 года.
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 4—54. — ISBN 978-1-4822-0868-9
- ↑ 1 2 Кальций уксуснокислый Химическая формула: Ca(CH3COO)2*H2O Синоним: Ацетат кальция, кальциевая соль уксусной кислоты, кальций ацетат Международное название: Сalcium acetate ||О … Дата обращения: 29 мая 2013. Архивировано из оригинала 12 декабря 2013 года.
- ↑ И. Я. Миттова, А. М. Самойлов, История химии с древнейших времен до конца XX века//М.: Химия, 2012
- ↑ Способ получения ацетата кальция. Патент РФ 2156757. Дата обращения: 1 июня 2013. Архивировано 15 марта 2014 года.
- ↑ СаОН вместо NaОН. Дата обращения: 5 мая 2020. Архивировано 14 сентября 2017 года.
- ↑ ГОСТ Р 54537-2011
- ↑ E263 — Ацетат кальция (Е263). Архивировано 5 июня 2013 года.
- ↑ Консервант Е263 (Ацетат кальция) » Пищевые добавки. Дата обращения: 30 мая 2013. Архивировано 7 августа 2013 года.
- ↑ Нефродин. Ацетат кальция — Аннотация. Архивировано 5 июня 2013 года.










