Аурин (Grjnu)
| Аурин | |
|---|---|
 | |
| Общие | |
| Хим. формула | C19H14O3 |
| Физические свойства | |
| Молярная масса | 290,32 г/моль |
| Классификация | |
| Рег. номер CAS | 603-45-2 |
| PubChem | 5100 |
| Рег. номер EINECS | 210-041-8 |
| SMILES | |
| InChI | |
| ChEBI | 34544 |
| ChemSpider | 4921 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Аурин (устаревшие названия — розоловая кислота, пэонин или красный кораллин) — один из первых искусственных органических красителей триарилметанового ряда, в XIX — начале XX века находил ограниченное применение в красильной технике, для окрашивания шерсти, малопрочнен по отношению к свету, щелочам (включая растворы мыл) и кислотам.
История
[править | править код]Аурин впервые был синтезирован (в виде смолообразной смеси с побочными продуктами), но не идентифицирована, в 1834 г. Рунге окислением сырого фенола из каменноугольной смолы, который назвал ее «розоловой кислотой» по аналогии с «карболовой кислотой» — фенолом. В 1861 г. Кольбе и Шмитт синтезировали красный краситель конденсацией щавелевой кислоты и фенола в присутствии серной кислоты (этот метод синтеза используется и поныне) и установили, что полученный ими краситель является очищенной розолевой кислотой Рунге. Структура аурина в то время оставалась неизвестной, элементный анализ аурина, сделанный Кольбе и Шмиттом, дал его брутто-формулу , что соответствовало сумме трех фенольных остатков и -фрагмента щавелевой кислоты. Однако дальнейшие исследования с синтезом аурина из очищенного фенола и по очистке самого аурина показали его брутто-формулу, содержащую на один атом углерода меньше, . Оказалось, что в ранних синтезах аурина использовался плохо очищенный фенол, загрязненный существенным количеством крезолов (изомерных метилфенолов), что и вело к образованию трудноразделяемой смеси аурина и метилауринов с «лишним» углеродом в результатах элементного анализа.
В настоящее время название «аурин» осталось за незамещенням продуктом, а «розолевая кислота» — за его метилпроизводными[1].
Синтез
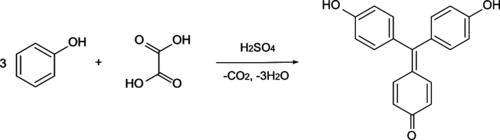
[править | править код]В настоящее время стандартным методом синтеза является конденсация фенола с щавелевой кислотой в присутствии серной кислоты:
На первой стадии происходит карбоксилирование фенола щавлевой кислотой до p-гидроксибензойной кислоты. Далее p-гидроксибензойная кислота ацилирует вторую молекулу фенола с образованием ди(p-гидроксифенил)кетона, который, в свою очередь, конденсируется с третьей молекулой фенола с образованием лейкоформы аурина - три(p-гидроксифенил)карбинола, после чего лейкоформа окисляется кислородом воздуха до аурина.
Аурин также может быть синтезирован конденсацией фенола с четыреххлористым углеродом в условиях реакции Фриделя-Крафтса, при этом образуется три(p-гидроксифенил)хлорметан, который гидролизуется до лейкоформы аурина, которая, в условиях гидролиза окисляется кислородом воздуха до аурина (выход до 35%)[2].
Свойства
[править | править код]
Малорастворим в воде, хорошо растворим в этаноле. в кислой среде растворы аурина окрашены в жёлтый цвет, в щелочной — в карминово-красный, pH перехода 6.6 — 8.0, максимумы поглощения в оптической области - 535.6 нм, 479.5 нм и 482 нм[3]
Используется в аналитической химии в качестве индикатора, входит в состав среды Гисса как индикатор закисления среды при метаболизме углеводов бактериальными культурами.
См. также
[править | править код]Примечания
[править | править код]- ↑ . Hartmann, Horst (2024-07-23). "On the discovery of the first synthetic dyes prepared from phenolic tar ingredients". Journal of Chemical Research. 48. doi:10.1177/17475198241262008.
- ↑ Gomberg, M.; Snow, H. R. THE CONDENSATION OF CARBON TETRACHLORIDE AND PHENOL: AURIN. ACS Publications (1 мая 2002). Дата обращения: 7 октября 2024.
- ↑ Sabnis, R. W. Handbook of Acid-Base Indicators. — CRC Press, 2007-10-04. — P. 30. — ISBN 978-0-8493-8219-2.
Литература
[править | править код]- The Invisible Industrialist. Manufactures and the Production of Scientific Knowledge / Gaudilliere J-P., Lowy I.. — New York: PALGRAVE MACMILLAN, 1998.
- Fay I. W. The chemistry of the coal-tar dyes (англ.). — New York: D. Van Nostrand Company, 1919.
Это заготовка статьи об органическом веществе. Помогите Википедии, дополнив её. |
Для улучшения этой статьи желательно:
|