Адсорбция (G;vkjQenx)
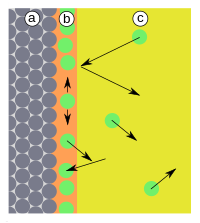
Адсорбция (лат. ad — на, при, в; sorbeo — поглощаю) — самопроизвольный процесс увеличения концентрации растворённого вещества у поверхности раздела двух фаз (твёрдая фаза — жидкость, конденсированная фаза — газ) вследствие нескомпенсированности сил межмолекулярного взаимодействия на разделе фаз[1]. Адсорбция является частным случаем сорбции, процесс, обратный адсорбции — десорбция[2].
Основные понятия
[править | править код]Поглощаемое вещество, ещё находящееся в объёме фазы, называют адсорбтив, поглощённое — адсорбат. В более узком смысле под адсорбцией часто понимают поглощение примеси из газа или жидкости твёрдым веществом (в случае газа и жидкости) или жидкостью (в случае газа) — адсорбентом. При этом, как и в общем случае адсорбции, происходит концентрирование примеси на границе раздела адсорбент-жидкость либо адсорбент-газ. Процесс, обратный адсорбции, то есть перенос вещества с поверхности раздела фаз в объём фазы, называется десорбция. Если скорости адсорбции и десорбции равны, то говорят об установлении адсорбционного равновесия. В состоянии равновесия количество адсорбированных молекул остается постоянным сколько угодно долго, если неизменны внешние условия (давление, температура и состав системы)[3].
Адсорбция и хемосорбция
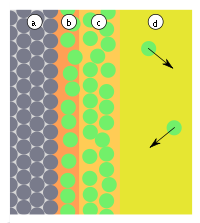
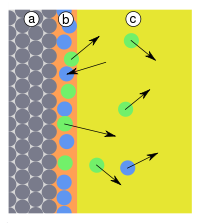
[править | править код]На поверхности раздела двух фаз помимо адсорбции, обусловленной в основном физическими взаимодействиями (главным образом это Ван-дер-Ваальсовы силы), может идти химическая реакция. Этот процесс называется хемосорбцией. Чёткое разделение на адсорбцию и хемосорбцию не всегда возможно. Одним из основных параметров, по которым различаются эти явления, является тепловой эффект: так, тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата, тепловой эффект хемосорбции значительно выше. Кроме того, в отличие от адсорбции, хемосорбция обычно является необратимой и локализованной, то есть происходит на определённых местах — активных центрах. Примером промежуточных вариантов, сочетающих черты и адсорбции, и хемосорбции, является взаимодействие кислорода на металлах и водорода на никеле: при низких температурах они адсорбируются по законам физической адсорбции, но при повышении температуры начинает протекать хемосорбция.
Схожие явления
[править | править код]В предыдущем разделе говорилось о случае протекания гетерогенной реакции на поверхности — хемосорбции. Однако бывают случаи гетерогенных реакций по всему объёму, а не только на поверхности: это обычная гетерогенная реакция. Поглощение по всему объёму может проходить и под воздействием физических сил. Этот случай называется абсорбцией.
| Виды взаимодействий | Взаимодействия только на поверхности | Взаимодействия по всему объёму |
|---|---|---|
| Физические | Адсорбция | Абсорбция |
| Химические | Хемосорбция | Гетерогенная реакция |
Физическая адсорбция
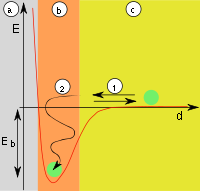
[править | править код]Причиной адсорбции являются неспецифические (то есть не зависящие от природы вещества) Ван-дер-Ваальсовы силы. Адсорбция, осложнённая химическим взаимодействием между адсорбентом и адсорбатом, является особым случаем. Явления такого рода называют хемосорбцией и химической адсорбцией. «Обычную» адсорбцию в случае, когда требуется подчеркнуть природу сил взаимодействия, называют физической адсорбцией.
Физическая адсорбция является обратимым процессом, условие равновесия определяется равными скоростями адсорбции молекул адсорбтива P на вакантных местах поверхности адсорбента S* и десорбции — освобождения адсорбата из связанного состояния S − P:
- ;
уравнение равновесия в таком случае:
- ,
где K — константа равновесия, [S − P] и [S*] — доли поверхности адсорбента, занятые и незанятые адсорбатом, а [P] — концентрация адсорбтива.
Количественно процесс физической мономолекулярной адсорбции в случае, когда межмолекулярным взаимодействием адсорбата можно пренебречь, описывается уравнением Ленгмюра:
- ,
где — доля площади поверхности адсорбента, занятая адсорбатом, — адсорбционный коэффициент Ленгмюра, а P — концентрация адсорбтива.
Поскольку и, соответственно, , уравнение адсорбционного равновесия может быть записано следующим образом:
Уравнение Ленгмюра является одной из форм уравнения изотермы адсорбции. Под уравнением изотермы адсорбции (чаще применяют сокращённый термин — изотерма адсорбции) понимают зависимость равновесной величины адсорбции от концентрации адсорбтива a=f(С) при постоянной температуре (T=const). Концентрация адсорбтива для случая адсорбции из жидкости выражается, как правило, в мольных либо массовых долях. Часто, особенно в случае адсорбции из растворов, пользуются относительной величиной: С/Сs, где С — концентрация, Сs — предельная концентрация (концентрация насыщения) адсорбтива при данной температуре. В случае адсорбции из газовой фазы концентрация может быть выражена в единицах абсолютного давления, либо, что особенно типично для адсорбции паров, в относительных единицах: P/Ps, где P — давление пара, Ps — давление насыщенных паров этого вещества. Саму величину адсорбции можно выразить также в единицах концентрации (отношение числа молекул адсорбата к общему числу молекул на границе раздела фаз). Для адсорбции на твёрдых адсорбентах, особенно при рассмотрении практических задач, используют отношение массы или количества поглощённого вещества к массе адсорбента, например мг/г или ммоль/г.
Значение адсорбции
[править | править код]Адсорбция — всеобщее и повсеместное явление, имеющее место всегда и везде, где есть поверхность раздела между фазами. Наибольшее практическое значение имеет адсорбция поверхностно-активных веществ и адсорбция примесей из газа либо жидкости специальными высокоэффективными адсорбентами. В качестве адсорбентов могут выступать разнообразные материалы с высокой удельной поверхностью: пористый углерод (наиболее распространённая форма — активированный уголь), силикагели, цеолиты, а также некоторые другие группы природных минералов и синтетических веществ. Адсорбционные свойства грунтов является важной характеристикой для инженерной геологии.
Адсорбция (особенно хемосорбция) имеет также важное значение в гетерогенном катализе. Пример адсорбционных установок приведён на странице азотные установки.
Установка для проведения адсорбции называется адсорбер.
См. также
[править | править код]- Абсорбция
- Сорбция
- Уравнение Вигнера — Поляни
- Островок адсорбированных частиц
- Покрытие поверхности адсорбатом
Примечания
[править | править код]- ↑ adsorption // IUPAC Gold Book. Дата обращения: 16 января 2013. Архивировано 27 ноября 2012 года.
- ↑ desorption // IUPAC Gold Book. Дата обращения: 16 января 2013. Архивировано 24 октября 2012 года.
- ↑ Саранин Александр Александрович, Смирнов Андрей Валентинович. Адсорбция: словарь нанотехнологических терминов. Роснано (CC-BY-SA 3.0). Дата обращения: 20 марта 2012. Архивировано 31 мая 2012 года.
Литература
[править | править код]- Фролов Ю. Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы. - М.: Химия, 1989. - 464 с.
- Кельцев Н. В. Основы адсорбционной техники. - М.: Химия, 1984. - 592 с.
- Грег С., Синг К. Адсорбция, удельная поверхность, пористость. - М.: Мир, 1984. - 310 с.*
- Адамсон А. Физическая химия поверхностей. – М.: Мир. 1979. – 568 с.
- Оура К., Лифшиц В. Г., Саранин А. А. и др. Введение в физику поверхности / Под ред. В. И. Сергиенко. — М.: Наука, 2006. — 490 с.
- Карнаухов А.П. Адсорбция. Текстура дисперсных и пористых материалов. — Новосибирск: Наука. 1999. — 470 с.
- Химическая энциклопедия. Т. 1. — М.: Советская энциклопедия, 1990. — 623 с.
- Полторак О.М. Термодинамика в физической химии. — М.: Высшая школа, 1991. — 319 с.
- Берёзкин В.И. Введение в физическую адсорбцию и технологию углеродных адсорбентов. — СПб.: Виктория плюс, 2013. — 409 с. — ISBN 978-5-91673-128-6
Ссылки
[править | править код]- Адсорбция // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.

![{\displaystyle K={\frac {[S-P]}{[S^{*}][P]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/099820cd3df2eaeabcbd924a448b8208fa7d5e1f)



![{\displaystyle [S-P]=\theta }](https://wikimedia.org/api/rest_v1/media/math/render/svg/18499216a897cbf17dcf59bba294bf2bc1a8c1f4)
![{\displaystyle [S^{*}]=1-\theta }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c8b75e1d1488049666cf5e3f2ec8075c3986b594)
